台灣外泌體公司獲衛福部GTP認證 進軍臨床級NK細胞製備 助力再生醫療產業發展

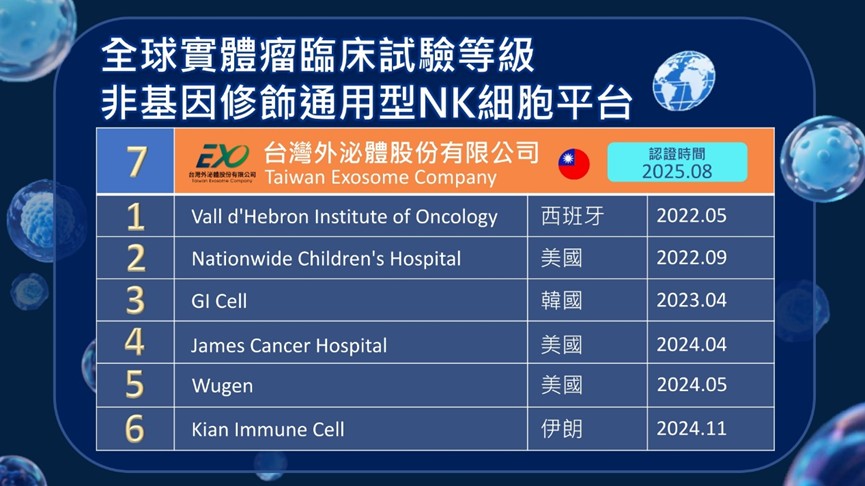
(生活中心/綜合報導)台灣外泌體股份有限公司(簡稱台灣外泌體)獲衛生福利部核可,其GTP(人體細胞組織優良操作規範)NK細胞製備場,成為台灣首家、全球第七家可提供臨床等級通用型、非配對與非基因修飾 NK細胞的製備平台。台灣外泌體具備支援臨床研究、免疫療法技術驗證的製備能量,進一步提升台灣細胞治療產業的國際鏈結機會。
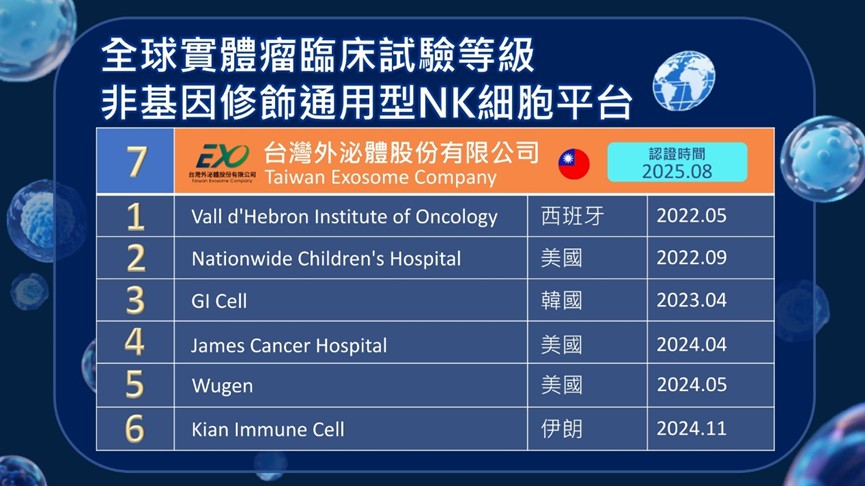
圖/全球七家臨床試驗等級通用型(非配對與非基因修飾)NK細胞製備平台。(資料來源:https://clinicaltrials.gov/)
結合法規優勢 拓展再生醫療發展契機
自2018年《特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法》上路以來,台灣已成為全球第二個有條件開放細胞治療的國家,為創新技術進入臨床提供合規路徑。目前已有超過60家企業投入再生醫學領域,台灣外泌體是其中率先取得GTP資格生產通用型、非配對與非基因修飾 NK細胞的技術平台,具備臨床級製備、品質控管、試驗規劃等完整能力。
「雙軌整合+三箭佈局」 建立平台長期發展基礎
台灣外泌體同時發展免疫細胞與外泌體兩大平台,並建立橫跨植物、動物與人體來源的研發路徑,打造可延展且模組化的外泌體平台,涵蓋保健產品開發、生技應用研究及臨床技術驗證等層面,以整合式外泌體技術為核心,推動從基礎研究到產業應用接軌,打造具國際合作潛力的創新平台。
與臨床合作 推動技術驗證與數據收集
目前,台灣外泌體已與林口長庚紀念醫院、成功大學附設醫院等醫療機構展開合作,提供自體或通用型NK細胞製品,進行技術驗證與數據收集。所有研究流程均依據衛生福利部食品藥物管理署及人體試驗委員會(IRB)嚴謹審查後執行,以確保合規與倫理要求。
產業規模高速成長 精準切入兩大高潛力市場
根據Global Market Insights資料:
- NK細胞相關應用市場:預計2030年規模將大幅成長,CAGR達43.1%。
- 外泌體市場:預估於2037年突破43.7億美元。
兩者皆為高技術門檻與成長性明確的細胞技術領域,台灣外泌體憑藉「多元研發+臨床鏈結」策略,逐步提升產業能見度與國際合作機會。
展望未來:從台灣出發,鏈結國際創新生態
台灣外泌體營運長暨技術長林杰良博士表示:「取得GTP核可是公司技術布局的重要里程碑,展現我們在製備、研發與臨床接軌上的整合能力。未來我們將持續深化與國際臨床單位合作,加速推進外泌體與免疫細胞平台的應用研究,進一步提升台灣在全球再生醫療領域的參與度。」